Новое исследование показало, что распространенные, обычно безвредные бактерии играют значительную роль в возникновении рака желудка. Они присоединяется к более известной, по крайней мере, в медицинских кругах, бактерии Helicobacter pylori (H. pylori) как известный фактор риска развития рака. Исследователи определили механизм действия бактерий, открыв путь к разработке методов лечения, позволяющих снизить риск заболевания.
Около половины населения мира является носителем обычно безвредной бактерии Helicobacter pylori. Хотя в медицинском сообществе хорошо известно, что, когда H. pylori становится патогенной, она может вызвать инфекцию, которая значительно увеличивает риск рака желудка или желудка, но только у 1–3% людей, инфицированных этой бактерией, развивается такое заболевание.
Низкий процент людей, у которых развивается рак желудка из-за инфекции H. pylori, заставил ученых задаться вопросом, существует ли дополнительный патоген, способствующий заболеванию. Это побудило исследователей из Наньянского технологического университета (NTU) в Сингапуре и Китайского университета Гонконга (CUHK) совместно провести исследование, посвященное изучению того, чем может быть этот микроб.
Исследователи изучили микробиом кишечника, не связанный с H. pylori, у пациентов с различными заболеваниями желудка: от поверхностного гастрита (воспаление слизистой оболочки желудка) до атрофического гастрита (истончение слизистой оболочки желудка и потеря клеток, которые выделяют вещества, способствующие пищеварению) до кишечной метаплазии (клетки слизистой оболочки желудка заменяются клетками, подобными кишечным клеткам), и, наконец, к раку.
Основные моменты
• S. anginosus накапливается в слизистой оболочке желудка больных РЖ.
• S. anginosus индуцирует последовательность гастрит-атрофия-метаплазия-дисплазия у мышей
• S. anginosus способствует развитию опухолей желудка.
• Ось TMPC-аннексин A2 опосредует колонизацию S. anginosus и активирует передачу сигналов MAPK.
Они обнаружили пять патогенов, содержащихся в слизистой оболочке желудка этих пациентов, включая Streptococcus anginosus.
S. anginosus является частью нормальной флоры рта, носа, горла, кишечника и влагалища. Обычно он не представляет проблемы для здоровых людей, но может вызвать оппортунистические инфекции, когда иммунная система организма ослаблена. Роль бактерий в развитии рака желудка, включая механизм его действия, остается во многом неясной.
Используя мышиные модели, исследователи обнаружили, что колонии S. anginosus инициирует острую воспалительную реакцию, за которой следует хроническая фаза с интенсивным и постоянным гастритом. Известно, что хроническое воспаление провоцирует рост и развитие рака. У мышей инфекция вызвала прогрессирование хронического гастрита к атрофии, метаплазии и дисплазии – тому же пути, по которому следуют люди, прежде чем у них разовьется рак желудка.
Кроме того, совместная инфекция S. anginosus и H. pylori приводила к более сильному воспалению желудка, чем любой из патогенов по отдельности, что позволяет предположить, что они могут действовать вместе, вызывая гастрит.
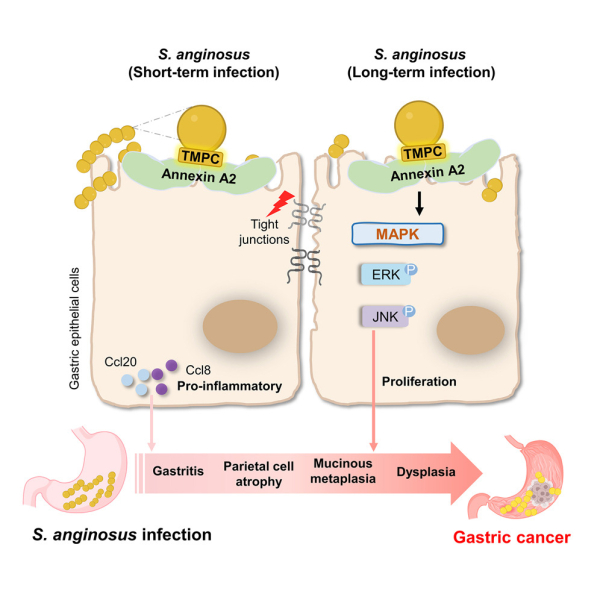
Исследование показывает, что S. anginosus является патогеном, который способствует канцерогенезу желудка посредством прямого взаимодействия с эпителиальными клетками желудка по оси TMPC-ANXA2-MAPK.
Введение S. anginosus стерильным мышам – мышам, рожденным без микроорганизмов внутри или на поверхности – вызвало те же предраковые изменения. Это означало, что одного S. anginosus, но не его взаимодействия с микробиомом желудка, было достаточно, чтобы вызвать появление рака.
«Инфекция H. pylori и семейный анамнез широко признаны двумя основными факторами риска развития рака желудка», — сказал Джозеф Сун Джао Ю, соавтор исследования и почетный профессор медицины в CUHK.
«Открытие накопления S. anginosus в слизистой оболочке желудка на разных стадиях рака открывает совершенно новое направление в понимании патогенеза рака желудка. Мы также хотим отметить, что совместная инфекция H. pylori и S. anginosus приводит к еще более высокому риску предраковой атрофии, метаплазии или рака желудка».
Исследователи изучили механизм, лежащий в основе этого процесса, и обнаружили, что S. anginosus использует свой поверхностный белок TMPC для связи с рецептором аннексина А2 (ANXA2) на клетках слизистой оболочки желудка.
Взаимодействие позволило бактериям прикрепиться к клетке и колонизировать ее, активируя митоген-активируемую протеинкиназу (MAPK), фермент, который координирует пролиферацию, дифференцировку и выживание клеток.
«Мы установили роль S. anginosus в канцерогенезе желудка и связанный с этим механизм; Далее мы изучим терапевтический потенциал его воздействия на снижение воспаления желудка и риска рака», — сказал Ю Цзюнь, директор Института заболеваний пищеварительной системы CUHK и один из авторов исследования.
Исследование было опубликовано в журнале Cell.





